Empezamos el 2015 en el blog, con una entrada dedicada a la historia de la ciencia y a, muy probablemente, uno de los químicos más importantes de la historia de la química, pero sin lugar a dudas, también, de la historia de la biología molecular y la bioquímica: Hermann Emil Fischer. A este químico orgánico de origen, bioquímico de profesión, se le considera el padre de la bioquímica, puesto que, gracias a su trabajo se obtuvo información sobre la estructura molecular de las principales moléculas biológicas, que repercutiría en el estudio de su funcionalidad y permitiría, también, a su síntesis en el laboratorio bajo otras condiciones.
 Hermann Emil Fischer (1852-1919), nació en Euskirchen, distrito de Colonia (Alemania), en el seno de una familia de empresarios de la madera. Gracias a su nula capacidad como hombre de negocios y al apoyo de su padre, estudió Química (en principio, sus preferencias tiraban más hacia la Física) en la Universidad de Bonn, en dónde entró en contacto con otros grandes químicos de la época como August Kekulé, pionero en la teoría de la estructura química
Hermann Emil Fischer (1852-1919), nació en Euskirchen, distrito de Colonia (Alemania), en el seno de una familia de empresarios de la madera. Gracias a su nula capacidad como hombre de negocios y al apoyo de su padre, estudió Química (en principio, sus preferencias tiraban más hacia la Física) en la Universidad de Bonn, en dónde entró en contacto con otros grandes químicos de la época como August Kekulé, pionero en la teoría de la estructura química
que describe que: «los átomos de carbono tenían la capacidad de, mediante su vinculación entre sí o con otros elementos, determinar el orden de unión de los átomos, definiendo su fórmula estructural. Sin embargo, sería un discípulo de Kekulé, Jacobus Henricus Van’t Hoff, Premio Nobel de Química en 1901, quién, a través de sus postulados sobre estereoquímica y estructuras tridimensionales, el que inspiraría a Emil Fischer a la hora de estudiar las estructuras de azúcares que le llevarían, junto con sus trabajos sobre purinas, a conseguir el Premio Nobel de Química en 1902, sólo un año después a Van’t Hoff.
Persuadido inicialmente por su primo, Otto Fischer y posteriormente, gracias a la dirección e influencia de Adolf von Baeyer, Fischer se traslada a la Universidad de Estrasburgo, en dónde descubre en 1875, las fenilhidrazinas, derivados primarios de la hidrazina (precursor de catalizadores de polimerización), que jugarían un papel muy importante en los estudios posteriores que realizaría en su carrera sobre estructuras moleculares. Aunque Fischer empezó trabajando sobre la estructura molecular de la cafeína y teobromina (presentes en café, té y chocolate, respectivamente), con el fin de poder sintetizarlas en su laboratorio, el trabajo por el que sería universalmente reconocido, sería el relacionado con los azúcares y purinas, que desarrolló entre los años 1882 y 1906. En 1884, Fischer define las purinas (del griego «pira» (ardiente) y del latín «urina» (orina) como las estructuras 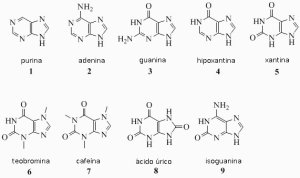 nitrogenadas bicíclicas de las que derivan otras sustancias (como la urea, adenina, guanina, xantina e incluso la cafeína), constituyentes de una familia homogénea de sustancias, que se diferencian entre sí, por la localización de diferentes estructuras químicas alrededor de estos núcleos bicíclicos nitrogenados. En 1892, Fischer sintetiza por primera vez purinas en su laboratorio, creando una familia de alrededor de 150 derivados artificiales de estas sustancias, que permitían refutar las afirmaciones llevadas a cabo, sobre su estructura, así como, permitían dar un paso importante hacia el estudio de la constitución de los ácidos nucleicos.
nitrogenadas bicíclicas de las que derivan otras sustancias (como la urea, adenina, guanina, xantina e incluso la cafeína), constituyentes de una familia homogénea de sustancias, que se diferencian entre sí, por la localización de diferentes estructuras químicas alrededor de estos núcleos bicíclicos nitrogenados. En 1892, Fischer sintetiza por primera vez purinas en su laboratorio, creando una familia de alrededor de 150 derivados artificiales de estas sustancias, que permitían refutar las afirmaciones llevadas a cabo, sobre su estructura, así como, permitían dar un paso importante hacia el estudio de la constitución de los ácidos nucleicos.
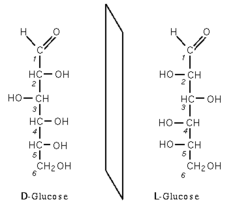
Coetáneamente en el tiempo, Emil Fischer comienza a estudiar la estructura de los azúcares. Hasta ese momento, sólo se conocían las propiedades de solubilidad, la fórmula molecular (C6H1206), la presencia de un grupo aldehído (positivo frente a reactivos de Tollents o Fehling) y el carácter óptico de la molécula de la glucosa. Fischer, trató de encontrar la forma estructural que presentaba el esqueleto de carbono, y la naturaleza, localización y posicionamiento espacial de sus grupos funcionales. Partiendo estos conocimientos y utilizando la fenilhidrazina, estableció una relación entre la glucosa, la fructosa y la manosa (los tres  azúcares simples sólo diferían en uno del otro, en dos posiciones), mediante el paso previo a fenilhidrazonas osazonas (combinación del ácido aldónico y la fenilhidrazina altamente cristalizable). Fischer pronto se dio cuenta, que muchos azúcares eran isómeros espaciales y podrían diferenciarse utilizando la teoría de Van’t Hoff. Según esta última, uno o más átomos de carbono que que están unidos a 4 sustituyentes, actúan como centros quirales o carbonos asiméticos, y pueden presentar dos configuraciones espaciales diferentes especulares (simétricas respecto a un plano) que se diferenciaban entre sí por la posición relativa de un único sustituyente y desviaban el plano de polarización de la luz de forma opuesta. . Además de recurrir a Van’t Hoff, Fischer también utilizó la demostración y explicación que Pasteur dio, utilizando el ácido tartárico, sobre lo que eran las moléculas enantiómeras;
azúcares simples sólo diferían en uno del otro, en dos posiciones), mediante el paso previo a fenilhidrazonas osazonas (combinación del ácido aldónico y la fenilhidrazina altamente cristalizable). Fischer pronto se dio cuenta, que muchos azúcares eran isómeros espaciales y podrían diferenciarse utilizando la teoría de Van’t Hoff. Según esta última, uno o más átomos de carbono que que están unidos a 4 sustituyentes, actúan como centros quirales o carbonos asiméticos, y pueden presentar dos configuraciones espaciales diferentes especulares (simétricas respecto a un plano) que se diferenciaban entre sí por la posición relativa de un único sustituyente y desviaban el plano de polarización de la luz de forma opuesta. . Además de recurrir a Van’t Hoff, Fischer también utilizó la demostración y explicación que Pasteur dio, utilizando el ácido tartárico, sobre lo que eran las moléculas enantiómeras; 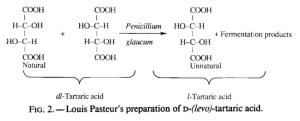 moléculas que, siendo químicamente idénticas (isómeros), muestran estructuras espaciales que son imágenes especulares, es decir, no son superponibles una sobre la otra (isómeros ópticos). Este aspecto químico, es fundamental para el estudio de las moléculas biológicas, puesto que, en función de como interaccionen con la luz polarizada, serán dextrógiras o formas D (desvía la luz polarizada hacia la derecha (en orientación con las manecillas del reloj); (+)) o si son levógiras o formas L (desvían la luz polarizada hacia la izquierda (en orientación contraria con las manecillas del reloj); (-)).
moléculas que, siendo químicamente idénticas (isómeros), muestran estructuras espaciales que son imágenes especulares, es decir, no son superponibles una sobre la otra (isómeros ópticos). Este aspecto químico, es fundamental para el estudio de las moléculas biológicas, puesto que, en función de como interaccionen con la luz polarizada, serán dextrógiras o formas D (desvía la luz polarizada hacia la derecha (en orientación con las manecillas del reloj); (+)) o si son levógiras o formas L (desvían la luz polarizada hacia la izquierda (en orientación contraria con las manecillas del reloj); (-)).
Utilizando esos conceptos, en 1890, Emil Fischer estableció la naturaleza
estereoquímica e isomería de los azúcares por medio de reacciones de epimerización entre que dan como resultado una mezcla racémica que conserva el centro quiral, y entre 1891 y 1894, consiguió predecir todos posibles isómeros ópticos (cada centro quiral o carbono asimétrico, da lugar a dos pares de enantiómeros; para la glucosa, serían 8 pares y hasta 16 isómeros ópticos) de los azúcares conocidos. Además, fue capaz de obtener nuevos azúcares no naturales, mediante reacciones de síntesis (síntesis de Kiliani-Fischer) y degradación, creando pentosas a partir de tetraosas, hexosas a partir de pentosas o, hexosas a partir de heptosas, siendo su mayor éxito, la síntesis de glucosa, fructosa y manosa, a partir de glicerol, usando ácido nítrico diluído y posteriormente una solución de alcali diluido, para obtener los compuestos precursores, denominados como acrosa.
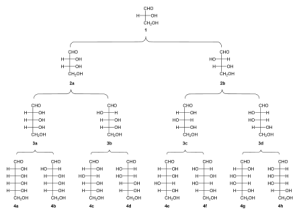
1) Triosa-D-gliceraldehído 2a)D-Eritrosa 2b) D-Treosa 3a) D-Ribosa 3b) D-Arabinosa 3c)D-Xilosa 3d)D-Lixosa 4a)D-Alosa 4b) D-Altrosa 4c) D-glucosa 4d) D-Manosa 4e) D-Gulosa 4f) D-Iosa 4g)D-galactosa 4h)D-Talosa // Se puede iniciar la serie enatiómerica levógira partiendo de Triosa – L- gliceraldehído.
Con el fin de representar tales isómeros en una página, desarrolló el sistema de «Proyección de Fischer», en el que se representa, en dos dimensiones, la disposición espacial de moléculas, por medio de líneas horizontales que representan los enlaces que se proyectan desde el plano del papel hacia el observador, y líneas verticales, que representan enlaces que se proyectan por detrás del plano del papel. 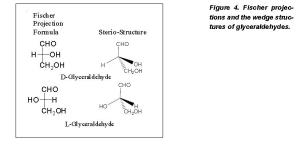 Es posible también otra representación, en dónde, los sustityentes que están a la derecha e izquierda del centro quiral, son los que se proyectan desde el plano del papel hacia el observador (situados por delante de dicho plano), mientras que los situados por arriba y abajo del centro quiral, son loos que estarían detrás del plano del papel.
Es posible también otra representación, en dónde, los sustityentes que están a la derecha e izquierda del centro quiral, son los que se proyectan desde el plano del papel hacia el observador (situados por delante de dicho plano), mientras que los situados por arriba y abajo del centro quiral, son loos que estarían detrás del plano del papel.
Entre 1899 y 1908, Emil Fischer llevó a cabo grandes aportaciones al conocimiento de las proteínas, empezando por el estudio de los glucósidos, en concreto la glucosamina (combinación de glucosa y aminoácidos), presente en el exoesqueleto de artrópodos. A partir de estos estudios, Fischer y colaboradores descubrieron, que había una gran variedad de proteínas que diferían entre sí, en cuanto a propiedades y complejidad estructural pero que, tenían en común, el estar constituidas por la combinación de muchas unidades más pequeñas, los aminoácidos. A través de la búsqueda de métodos eficaces para la separación e identificación de aminoácidos, en 1902, Emil consiguió descubrir dos nuevos aminoácidos cíclicos: la prolina y la oxiprolina.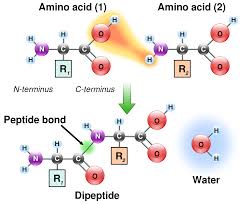 También, trató de estudiar la síntesis de proteínas mediante la unión de diferentes aminoácidos con formas ópticamente activas, siendo capaz finalmente en 1902, y junto con la ayuda Franz Hofmeister, de definir el enlace peptídico. Gracias a ello, consiguió sintetizar junto con Ernest Forneau, dipéptidos como el dipéptido glicil-glicina , tripéptidos y polipéptidos, así como también hidrolizarlos (caso de la caseína de la leche).Todo ello, condujo a un mayor conocimiento de las proteínas y al posterior estudio en profundidad, de las llamadas «macromoléculas«.
También, trató de estudiar la síntesis de proteínas mediante la unión de diferentes aminoácidos con formas ópticamente activas, siendo capaz finalmente en 1902, y junto con la ayuda Franz Hofmeister, de definir el enlace peptídico. Gracias a ello, consiguió sintetizar junto con Ernest Forneau, dipéptidos como el dipéptido glicil-glicina , tripéptidos y polipéptidos, así como también hidrolizarlos (caso de la caseína de la leche).Todo ello, condujo a un mayor conocimiento de las proteínas y al posterior estudio en profundidad, de las llamadas «macromoléculas«.
Emil Fischer, además de todo lo descrito, también será recordado por el establecimiento en 1890, del modelo «Lock and Key» o «llave/cerradura» con el que trataba de visualizar la interacción existente entre la enzima y su sustrato. Este modelo, surgió a partir de los estudios con dos isómeros, alfa-metilglucósido y beta-metilglucósido, preparados a partir de una metilación de la glucosa que, exhibían una especificidad total ante ciertas enzimas hidrolíticas. 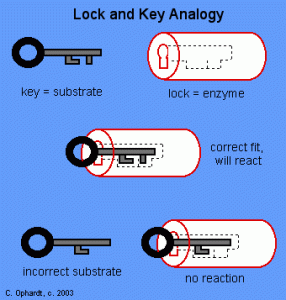 Fischer encontró que, el isómero alfa se hidrolizaba por medio de la enzima invertina (extraída de una levadura), mientras que, el isómero beta, se hidroliza por medio de la enzima emulsina (extraída de almendras); si intercambiaba las enzimas, la hidrólisis no tenía lugar sorprendentemente. Este hecho, le llevó a pensar que, los sustratos actuaban como llaves únicas que sólo podían abrir una determinada cerradura (enzima), asociando la función del enzima a una complementariedad entre su forma y la del sustrato. Sin embargo, este concepto no iba asociado a una idea de tridimensionalidad molecular, porque en ese momento, nadie podía planteárselo. No obstante, este hallazgo resultó ser fundamental para la explicación de ciertos procesos bioquímicos, aunque a día de hoy, se sepa que no permite explicar la estabilidad de la enzima en la etapa o estado de transición.
Fischer encontró que, el isómero alfa se hidrolizaba por medio de la enzima invertina (extraída de una levadura), mientras que, el isómero beta, se hidroliza por medio de la enzima emulsina (extraída de almendras); si intercambiaba las enzimas, la hidrólisis no tenía lugar sorprendentemente. Este hecho, le llevó a pensar que, los sustratos actuaban como llaves únicas que sólo podían abrir una determinada cerradura (enzima), asociando la función del enzima a una complementariedad entre su forma y la del sustrato. Sin embargo, este concepto no iba asociado a una idea de tridimensionalidad molecular, porque en ese momento, nadie podía planteárselo. No obstante, este hallazgo resultó ser fundamental para la explicación de ciertos procesos bioquímicos, aunque a día de hoy, se sepa que no permite explicar la estabilidad de la enzima en la etapa o estado de transición.
Durante los últimos años de su vida, Emil Fischer estudió la estructura molecular de las grasas, así como, la estructura química de ciertas sustancias utilizadas en el curtido de pieles. La gastritis que padecía desde joven, su trágica vida personal (la muerte prematura de su esposa e hijos mayores) y el cáncer terminal diagnosticado (probablemente por la elevada exposición a la fenilhidrazina), acabaron con la vida de uno de los científicos mas brillantes y adelantados de su tiempo.
Espero que os haya gustado saber los orígenes de la bioquímica, una disciplina altamente compleja pero apasionante. ¡Nos «leemos» en la próxima entrada!
Tatiana DC
Fuentes
Fischer, E. “Syntheses in the purine and sugar group”Nobel Lecture, December 12, 1902 ; Valpuesta, J.M. Dossier científico «Relaciones históricas entre la química, la bioquímica y la biología molecular” SEBBM-169 (2011) ; G Nagendrappa. «Hermann Emil Fischer: Life and Achievements!» Indian Academic of Science. Resonance (2011) http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-bio.html http://www.chemheritage.org/discover/online-resources/chemistry-in-history/themes/molecular-synthesis-structure-and-bonding/fischer.aspx http://historico.oepm.es/museovirtual/contenido/grandes_inventores_ficha.asp?tipo=INVENTOR&idm=es&sep=7&xml=Emil%20Fischer http://en.wikipedia.org/wiki/Hermann_Emil_Fischer

Debe estar conectado para enviar un comentario.