Il Nobel per la Medicina a William G. Kaelin Jr, Peter J. Ratcliffe e Gregg L. Semenza
"Per le loro scoperte su come le cellule percepiscono e si adattano alla disponibilità di ossigeno"

Il premio Nobel per la Medicina 2019 è stato assegnato a William G. Kaelin Jr, Peter J. Ratcliffe e Gregg L. Semenza “per le loro scoperte su come le cellule percepiscono e si adattano alla disponibilità di ossigeno”. Grazie ai loro studi, hanno identificato i meccanismi che a livello molecolare regolano l’attività dei geni a seconda dei livelli di ossigeno di cui possono disporre le cellule. Queste ricerche hanno permesso di comprendere come la variazione di ossigeno modifichi il metabolismo delle cellule e alcune delle loro funzionalità. Le scoperte hanno inoltre aperto la strada a nuovi ambiti di ricerca per contrastare patologie come l’anemia e per il trattamento di alcune forme di tumore.
L’ossigeno è un elemento essenziale per buona parte degli esseri viventi. Praticamente tutti gli animali lo utilizzano a livello dei mitocondri, i componenti delle cellule (organelli) che convertono il cibo in energia. Dagli anni Trenta, sappiamo che questo processo di conversione è regolato dagli enzimi e che nel corso dell’evoluzione il meccanismo si è raffinato, per fare in modo che il rifornimento di ossigeno verso i vari tessuti degli organismi degli animali sia regolare. Per esempio, nelle carotidi, tra i vasi sanguigni più importanti e che si trovano nel collo, ci sono cellule specializzate che hanno il compito di percepire i livelli di ossigeno nel sangue. Queste cellule hanno un ruolo primario nella regolazione del nostro respiro e comunicano direttamente con il cervello.
Negli organismi ci sono diversi altri meccanismi che consentono di tenere sotto controllo i livelli di ossigeno ed evitare di trovarsi in carenza (ipossia), con rischi molto alti per la salute. Una risposta all’ipossia viene innescata dall’eritropoietina (EPO), un ormone che ha la capacità di indurre una maggiore produzione di globuli rossi (il cui compito principale è proprio il trasporto di ossigeno). L’importanza dell’EPO era nota dall’inizio del secolo scorso, ma non era invece chiaro come funzionasse l’intero meccanismo di regolazione dell’ossigeno.
E qui entra in scena Gregg Semenza, uno dei premi Nobel per la Medicina di quest’anno. Incuriosito dall’EPO, si mise a studiarne il gene che la produce. Utilizzando alcune cavie di laboratorio geneticamente modificate, scoprì che c’erano altri segmenti di DNA – oltre al gene dell’EPO – che contribuivano al meccanismo che si attiva in caso di ipossia. Sir Peter Ratcliffe condusse ricerche nello stesso settore, arrivando a concludere come Semenza che il meccanismo per rilevare l’ossigeno e i suoi livelli era presente in quasi tutti i tessuti, e non solo nelle cellule dei reni dove viene prodotta l’EPO. Questa scoperta portò a ipotizzare che il sistema di reazione ai vari livelli di ossigeno fosse generalizzato nell’organismo e coinvolgesse tipi diversi di cellule.
Nei suoi studi successivi, Semenza scoprì un complesso proteico che avrebbe poi chiamato HIF (Hypoxia Inducible Factor): nel 1995 riuscì a isolare i geni contenenti le istruzioni per produrlo. Questo passaggio fu fondamentale per comprendere come funzionasse effettivamente il sistema per rilevare e regolare i livelli di ossigeno nell’organismo.
Le ricerche successive portarono alla scoperta dentro HIF di due fattori di trascrizione, cioè proteine che controllano la trascrizione delle informazioni genetiche dal DNA all’RNA messaggero, per la sintesi delle proteine. I due fattori furono chiamati: HIF-1α e ARNT.
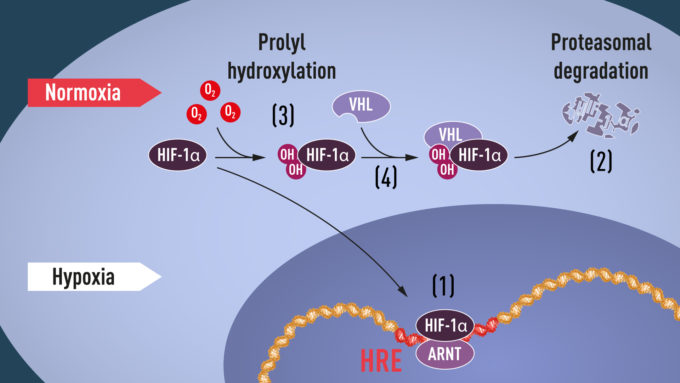
Quando i livelli di ossigeno sono alti, nelle cellule ci sono quantità molto basse di HIF-1α. Viceversa, la presenza del fattore di trascrizione aumenta quando l’ossigeno è basso, avviando quindi il meccanismo che regola il gene dell’EPO. In condizioni di normali livelli di ossigeno nella cellula, il proteasoma (che ha il compito di fare pulizia tra le catene di amminoacidi, i polipeptidi) degrada HIF-1α evitando che si accumuli in maniera anomala. Il proteasoma sa cosa deve degradare badando a una particolare “etichetta”, un polipeptide che si chiama “ubiquitina” e che si attacca alle proteine destinate a essere degradate. Nel caso dell’HIF-1α, l’ubiquitina si attacca solamente a certi livelli di ossigeno, ma nessuno sapeva bene come riuscisse a farlo.
Ci arrivò il ricercatore William Kaelin Jr., premiato quest’anno con il Nobel per la Medicina, mentre studiava la sindrome di von Hippel-Lindau (VHL), una malattia genetica che fa aumentare sensibilmente il rischio di ammalarsi di alcuni tipi di tumori. Kaelin scoprì che il gene VHL è coinvolto nei meccanismi di regolazione dell’ossigeno nelle cellule e ulteriori studi dimostrarono che VHL fa parte di un complesso che ha il compito di etichettare le proteine con l’ubiquitina, in modo che poi possa occuparsene il proteasoma. Partendo dai risultati di Kaelin e dei suoi colleghi, Ratcliffe scoprì che VHL interagisce fisicamente con HIF-1α e che è necessario per degradarlo a normali livelli di ossigeno. Era stato trovato il nesso mancante.
Studi successivi avrebbero permesso di scoprire ai Nobel per la Medicina di quest’anno che, con normali livelli di ossigeno, nella cellula avviene una modifica a livello proteico che consente a VHL di riconoscere e legarsi a HIF-1α, in modo che possa essere disgregato.
(Nobel Prize)
Semplificando molto: quando i livelli di ossigeno sono bassi (ipossia), HIF-1α viene protetto dai normali meccanismi di degradazione e si accumula nel nucleo della cellula, dove si lega ad ARNT e a specifiche sequenze del DNA per fare esprimere geni regolati proprio dall’ipossia. A livelli normali di ossigeno, HIF-1α viene costantemente degradato dal proteasoma. È l’ossigeno stesso a regolare la degradazione, attraverso l’aggiunta di gruppi ossidrilici (OH) a HIF-1α. La proteina VHL può allora riconoscere e formare un complesso con HIF-1α che porterà alla sua disgregazione, in un modo dipendente dalla quantità di ossigeno disponibile.
Questo complesso sistema di regolazione è fondamentale per la nostra esistenza e per quella di buona parte degli animali. La capacità di percepire i livelli di ossigeno aiuta le cellule a regolare il loro metabolismo, soprattutto nelle situazioni in cui hanno a disposizione minori quantità di questo elemento (per esempio quando facciamo un esercizio fisico molto intenso). Il meccanismo è inoltre alla base di diverse altre attività, come la regolazione del sistema immunitario, la produzione di nuovi globuli rossi e, nel feto, per lo sviluppo dei vasi sanguigni e della placenta.
Negli ultimi anni i ricercatori si sono concentrati sullo studio di questo sistema perché riviste un ruolo molto importante nel cancro. Alcuni tipi di tumore sfruttano il meccanismo per modificare il metabolismo delle cellule e favorire la proliferazione delle cellule cancerose. Per questo motivo si stanno studiando farmaci che possano intervenire per modulare il sistema di regolazione dell’ossigeno, in modo da trattare i tumori e altre gravi malattie con maggiore efficacia.
William G. Kaelin Jr è nato nel 1957 a New York e lavora presso l’Howard Hughes Medical Institute dal 1998.
Sir Peter J. Ratcliffe è nato nel 1954 a Lancashire (Regno Unito) ed è il direttore della Clinical Research at Francis Crick Institute di Londra.
Gregg L. Semenza è nato nel 1956 a New York ed è docente presso la Johns Hopkins University.